El 29 de noviembre de 2017 se suscribe el Convenio entre el Ministerio de Economía, Industria y Competitividad y el Servicio Extremeño de Salud (SES) para el proyecto «Sistema de Medicina Personalizada Aplicada-MEDEA» cofinanciado con FEDER.
En cumplimiento de lo dispuesto en el artículo 48.8 de la Ley 40/2015, de 1 de octubre, de Régimen Jurídico del Sector Público, procede la publicación en el «Boletín Oficial del Estado» de dicho convenio.
En su virtud resuelvo:
Único.
Hacer público el citado Convenio, cuyo texto figura en anexo a esta Resolución, mediante su publicación en el «Boletín Oficial del Estado».
Madrid, 29 de mayo de 2018.–El Secretario General de Ciencia e Innovación, Juan María Vázquez Rojas.
ANEXO
Convenio entre el Ministerio de Economía, Industria y Competitividad y el Servicio Extremeño de Salud (SES) para el proyecto «Sistema de Medicina Personalizada Aplicada»-«MEDEA» cofinanciado con FEDER
En Madrid, a 29 de noviembre de 2017.
REUNIDOS
De una parte, don Juan María Vázquez Rojas, Secretario General de Ciencia e Innovación, cargo que ostenta en virtud del nombramiento efectuado por el Real Decreto, 569/2016, de 25 de noviembre, actuando en nombre y representación del Ministerio de Economía, Industria y Competitividad, de acuerdo a la delegación de competencias efectuada por Resolución de la Secretaria de Estado de Investigación, Desarrollo e Innovación, de 1 de julio de 2016 (BOE de 6 de julio de 2016), ratificada por Orden EIC/1828/2016 de 24 de Noviembre (BOE de 30 de noviembre de 2016).
De otra parte, don Ceciliano Franco Rubio, Director Gerente, nombrado por Decreto 194/2015 (DOE 18 de Julio de 2.015) de acuerdo con lo establecido en los artículos 23.o) y 36.g) de la Ley 1/2002, de 28 de febrero, del Gobierno y de la Administración de la Comunidad Autónoma de Extremadura y en la Ley 39/2015, de 1 de octubre, del Procedimiento Administrativo Común de las Administraciones Públicas.
Reconociéndose plena capacidad para celebrar el presente Convenio,
EXPONEN
1. Que de acuerdo al Reglamento (UE) n.º 1303/2013 del Parlamento Europeo y del Consejo, de 17 de diciembre de 2013, por el que se establecen disposiciones comunes relativas al Fondo Europeo de Desarrollo Regional, al Fondo Social Europeo, al Fondo de Cohesión, al Fondo Europeo Agrícola de Desarrollo Rural y al Fondo Europeo Marítimo y de la Pesca, y por el que se establecen disposiciones generales relativas al Fondo Europeo de Desarrollo Regional, al Fondo Social Europeo, al Fondo de Cohesión y al Fondo Europeo Marítimo y de la Pesca, y se deroga el Reglamento (CE) Nº 1083/2006 del Consejo, al Reglamento (UE) n.º 1301/2013 del Parlamento Europeo y del Consejo, de 17 de diciembre de 2013, sobre el Fondo Europeo de Desarrollo Regional y sobre disposiciones específicas relativas al objetivo de inversión en crecimiento y empleo y por el que se deroga el Reglamento (CE) n.º 1080/2006, los criterios de selección de operaciones cofinanciadas por el Fondo Europeo de Desarrollo Regional se establecen en los correspondientes Comités de Seguimiento de los Programas Operativos aprobados por Decisión de la Comisión Europea.
2. Que corresponde al Estado el «fomento y coordinación general de la investigación científica y técnica», de acuerdo con el artículo 149.1.15 de la Constitución. De forma específica, según el Real Decreto 415/2016, de 3 de noviembre, por el que se reestructuran los departamentos ministeriales, y se crea el Ministerio de Economía, Industria y Competitividad (en adelante MEIC), corresponde a éste la propuesta y ejecución de la política del Gobierno en materia de investigación científica, desarrollo tecnológico e innovación en todos los sectores, y de forma más específica a la Secretaría General de Ciencia e Innovación (en adelante SGCi) le corresponde el impulso de la compra pública innovadora. Todo ello de acuerdo con los objetivos que se concretan en la Estrategia Española de Ciencia y Tecnología y de Innovación 2013-2020 (EECTI) y en el Plan Estatal de Investigación Científica y Técnica y de Innovación 2013-2016 junto con las orientaciones de la Comisión Europea sobre construcción del Espacio Europeo de Investigación y las directrices estratégicas comunitarias en materia de cohesión.
La Estrategia Española de Ciencia, Tecnología y de Innovación 2013-2020 (EECTI) constituye el marco estratégico para las políticas de I+D+i estatales y autonómicas y es el marco de referencia del Programa Operativo FEDER de Crecimiento Inteligente 2014-2020 (POCInt), documento en el que se concreta la estrategia y los objetivos de intervención de la Administración General del Estado (AGE) cofinanciadas con el fondo FEDER.
La EECTI recoge cuatro grandes objetivos generales, alineados con los objetivos de la Estrategia UE2020 y de Horizonte 2020 y contempla el desarrollo de las medidas necesarias para corregir las debilidades del Sistema.
A nivel estatal, la EECTI se desarrolla mediante el Plan Estatal de Investigación Científica y Técnica y de Innovación 2013-2016 y sus Planes Anuales de Actuación, constituyendo el conjunto el marco estratégico estatal de investigación e innovación para la especialización inteligente (RIS3 estatal).
3. Que la iniciativa emblemática de Europa 2020 «Unión por la innovación» reconoce la importancia del mercado de la contratación pública y su elevado potencial para impulsar la innovación. En este sentido, la contratación pública de productos y servicios innovadores es primordial para mejorar la calidad y la eficiencia de los servicios públicos, especialmente en un contexto de restricciones presupuestarias. La iniciativa establece que las administraciones públicas deben utilizar la contratación pública cofinanciada por los fondos estructurales para aumentar la demanda de productos y servicios innovadores. En el mismo sentido, la Directiva 2014/24/UE del Parlamento Europeo y del Consejo, de 26 de febrero de 2014, sobre contratación pública, establece que la investigación y la innovación son uno de los principales motores del crecimiento futuro, y recomienda a los poderes públicos hacer la mejor utilización estratégica posible de la contratación pública para fomentar la innovación. Asimismo, afirma el papel clave de la adquisición de bienes, obras y servicios innovadores en la mejora de la eficiencia y la calidad de los servicios públicos.
A fin de coordinar las actuaciones recogidas en el POCInt y en los Programas Operativos Regionales dentro del OT1, hay que señalar que el objetivo general del POCInt dentro del OT1 es fortalecer las capacidades en I+D+i que permitan el desarrollo de vínculos y la creación de sinergias entre el sector público y el sector empresarial, así como estimular la inversión empresarial en I+D+i, a través de instrumentos tanto de oferta como de demanda, contribuyendo a mejorar la competitividad empresarial apoyada en la innovación y la creación de empleo de alto valor añadido. En el caso de actuaciones de Compra Pública Innovadora, las actuaciones de la AGE van dirigidas a fomentar y coordinar proyectos en los que participen entidades de las distintas Comunidades Autónomas.
4. Que el Servicio Extremeño de Salud (en adelante SES) es un organismo autónomo de carácter administrativo, según lo recogido en la Ley 10/2001, de 28 de junio, de Salud de Extremadura y tiene entre sus funciones la prestación de servicio público universal, que proporciona cobertura sanitaria a toda la población de la Comunidad Autónoma de Extremadura. El SES es un organismo autónomo de carácter administrativo, adscrito a la Consejería competente en materia sanitaria, dotado de personalidad jurídica propia y plena capacidad de obrar para el cumplimiento de sus fines, disponiendo de tesorería propia y facultades de gestión del patrimonio afecto.
El SES es, por tanto, un organismo de derecho público de acuerdo a la definición contemplada en el artículo 2.1.4 de la Directiva 2014/24/UE del Parlamento Europeo y del Consejo, de 26 de febrero de 2014, sobre contratación pública y tiene entre sus funciones: la planificación, organización, dirección y gestión de los centros y de los servicios sanitarios adscritos al mismo, y que operen bajo su dependencia orgánica y/o funcional; la prestación de la atención sanitaria; la planificación, organización, dirección y gestión de los recursos humanos, materiales y financieros que le estén asignados para el desarrollo de las funciones que tenga encomendadas y aquellas que se le atribuyan reglamentariamente.
5. Que el SES, en la ejecución de este proyecto, se someterá a lo dispuesto en el Real Decreto Legislativo 3/2011, de 14 de noviembre, que refunde el texto de la Ley de contratos del Sector Público.
6. Que el SES conoce los Reglamentos Comunitarios y legislación estatal vigentes en materia de I+D+i.
7. Que el SES cuenta en sus presupuestos con créditos suficientes que permiten asegurar la cofinanciación global del proyecto.
8. Que el MEIC ha analizado el proyecto que responde a las necesidades de desarrollo económico de la Comunidad Autónoma de Extremadura y considera que deben ser objeto de cofinanciación por el FEDER aquellos con mayor capacidad de transformar los resultados de la investigación en productos y servicios de alto valor añadido, nuevos y sensiblemente mejorados, potenciando la transferencia de los resultados de actuaciones científicas y tecnológicas a empresas productoras de bienes o servicios.
9. Que el MEIC valora la contribución del proyecto objeto de ayuda al desarrollo socioeconómico y la competitividad del tejido empresarial del entorno, así como a la integración del sistema ciencia, tecnología, empresa y a la mejora de los servicios públicos mediante la incorporación de bienes o servicios innovadores.
El MEIC, en relación al Proyecto «Sistema de Medicina Personalizada Aplicada-MEDEA» ha seguido el procedimiento establecido para la selección de operaciones FEDER de la Línea Línea FID-Fomento de la Innovación desde la Demanda y de la Compra Pública Innovadora (Código de actuación DGIC-004 del Programa Operativo Crecimiento Inteligente del FEDER) aprobado el 3 de mayo de 2016.
Igualmente el MEIC ha considerado, dentro de los criterios de selección de operaciones de los Fondos, que el proyecto «Sistema de Medicina Personalizada Aplicada-MEDEA» se enmarca dentro de los contemplados en el objetivo de difundir el conocimiento y de la cooperación público-privada entre agentes científico-tecnológicos y empresas, apoyando, para ello, a proyectos que estimulen la competitividad empresarial mediante la realización de actividades de I+D+i en las regiones más desarrolladas por parte de la SGCi.
10. Que el SES manifiesta que la totalidad de las actuaciones irán encaminadas a la mejora de servicios públicos universales, no de mercado y/o que no generen efectos de distorsión de mercado.
11. Que el SES manifiesta que velará porque las actuaciones impulsen el fomento de la innovación empresarial, a través del empleo de la compra pública innovadora, en coordinación con el MEIC. A tales efectos el SES procurará maximizar el número de soluciones innovadoras puestas en mercado como resultado del presente convenio de colaboración.
Por todo ello, las partes acuerdan celebrar el presente convenio que se regirá por las siguientes
CLÁUSULAS
Primera. Objeto del Convenio.
El objeto del presente convenio es establecer la colaboración entre las partes para contribuir a la mejora de los servicios públicos, a través del fomento de la innovación empresarial, mediante la selección de las actuaciones y proyectos reflejados en la cláusula segunda para su cofinanciación por el FEDER 2014-2020.
Asimismo mediante el presente convenio se establecen las obligaciones y derechos del SES, beneficiario de los fondos FEDER, aplicados para la ejecución del antedicho proyecto.
Segunda. Actuaciones y Proyectos a ejecutar.
Las actividades relacionadas con el proyecto «Sistema de Medicina Personalizada Aplicada-MEDEA» que se llevarán a cabo y serán objeto de cofinanciación, en particular por el FEDER 2014-2020, son las señaladas en el Anexo I. Todas las actuaciones quedan sujetas a su correcta realización y justificación en los términos recogidos en este convenio y sus anexos.
Tercera. Obligaciones del MEIC.
a) El MEIC aportará al SES la cantidad de cuatro millones trescientos setenta y dos mil quinientos noventa y ocho euros en concepto de anticipo reembolsable FEDER, con cargo a la aplicación presupuestaria 27.12.463B.823 o la que la sustituya en futuros presupuestos, para ejecutar el proyecto reflejado en la cláusula segunda de acuerdo a la memoria y presupuesto presentados (anexo I), lo que se aportará en los términos reflejados en los anexos X y XI correspondientes al Tramo I o fase de I+D+i:
El primer libramiento se realizará a la firma del convenio.
•El segundo libramiento se realizará a los 2 años desde la firma del convenio, tras la justificación del primer libramiento y al menos el 10% de la cofinanciación total que debe aportar el beneficiario según lo establecido en la cláusula quinta (el MEIC, como Organismo Intermedio del Programa Operativo Crecimiento Inteligente del FEDER, certificará anualmente a la Autoridad de Gestión los gastos elegibles justificados y verificados antes del 1 de octubre de cada año por el SES.)
Los importes correspondientes a cada libramiento son los recogidos en el anexo XI.
b) El importe total del proyecto asciende a 5.465.747 euros (cinco millones cuatrocientos sesenta y cinco mil setecientos cuarenta y siete), con la siguiente distribución:
|
Fase |
Presupuesto (€) |
Modalidad |
Presupuesto según modalidad (€) |
|
Tramo I (Fase I+D) |
5.465.747 |
||
|
Anticipo reembolsable |
4.372.598 |
||
|
Contribución beneficiario |
1.093.149 |
||
|
Total (€) |
5.465.747 |
5.465.747 |
c) Del importe mostrado en el cuadro anterior correspondiente a la modalidad de anticipo reembolsable, el FEDER financia un 80 %, cuatro millones trescientos setenta y dos mil, quinientos noventa y ocho euros, y el 20 % restante, un millón, noventa y tres mil, ciento cuarenta y nueve euros, es la aportación nacional a través de la contraparte el SES.
d) Los libramientos se realizarán mediante transferencia bancaria a la siguiente cuenta y entidad bancaria: ES69 2085 4511 99 0331958586, Banco Ibercaja, de conformidad a lo previsto en el anexo XI.
e) El SES, al encontrarse sujeto al régimen presupuestario público, deberá registrar un ingreso por el importe del anticipo reembolsable recibido, aplicado al capítulo 9 «Pasivos financieros» de su presupuesto.
Cuando se reciban los fondos del FEDER, el Ministerio informará al SES de esta circunstancia, de modo que podrán reconocer la subvención recibida de la Unión Europea mediante un ingreso en el concepto que corresponda en el artículo 79 «Transferencias de capital del exterior», lo que a su vez permitirá la formalización de la cancelación de la deuda que quedó registrada en el momento del anticipo de fondos por parte del Estado, mediante el correspondiente pago en el capítulo 9 de su presupuesto de gastos.
La cancelación del anticipo reembolsable FEDER se realizará en formalización, sin salida física de fondos. Si el retorno de los fondos FEDER provenientes de la financiación europea no fueran suficientes para amortizar los fondos anticipados, SES reintegrará la diferencia en el Tesoro Público más los eventuales intereses. En el caso de existir remanentes no aplicados a la actividad financiada, si el reintegro se realizara de forma voluntaria antes del vencimiento del plazo para ejecutar la actividad, se aplicará el interés previsto en el artículo 17 de la Ley 7/2003, de 26 de noviembre, General Presupuestaria, por aplicación del artículo 77 de la misma. Cuando SES no reintegre de forma voluntaria, el Ministerio procederá con el Acuerdo de Inicio del Procedimiento de Reintegro, aplicándose el interés de demora establecido en el artículo 38.2 de la Ley 38/2003, de 17 de noviembre, General de Subvenciones. El periodo de cálculo de intereses se iniciará desde la fecha de pago hasta la fecha de reintegro voluntario, o hasta la fecha de resolución del procedimiento de reintegro.
f) A los efectos de la certificación y cancelación del Tramo I (anticipo reembolsable FEDER), el MEIC, como Organismo Intermedio del Programa Operativo Crecimiento Inteligente del FEDER, certificará anualmente a la Autoridad de Gestión los gastos elegibles justificados y verificados antes del 1 de octubre de cada año.
Estos retornos alcanzarán una cuantía máxima del 80 % del importe del gasto total elegible de las actuaciones presupuestadas para el Tramo I (Fase de I+D) en el anexo I y en el anexo XI que ascienden a cinco millones cuatrocientos sesenta y cinco mil setecientos cuarenta y siete euros; por tanto la aportación del FEDER será de cuatro millones trescientos setenta y dos mil quinientos noventa y ocho euros, la de la contraparte será de el SES de un millón noventa y tres mil ciento cuarenta y nueve euros, cada uno proporcionalmente a su participación en el presupuesto.
Cuarta. Obligaciones del beneficiario SES.
a) El SES, que será beneficiario de las ayudas FEDER, se compromete a realizar las actuaciones y a efectuar los gastos elegibles comprometidos para la finalidad con que aparecen en los anexos I, X y XI del convenio para la fase de I+D (Tramo I), por un importe total de cinco millones cuatrocientos sesenta y cinco mil, setecientos cuarenta y siete euros, a justificar los mismos ante la SGCi y a ir librando las cantidades correspondientes a la cofinanciación a medida que se vayan realizando las distintas actuaciones del Tramo I (Fase de I+D) de los anexos I y XI.
b) El SES, en la ejecución de este proyecto, se someterá a lo dispuesto en el Real Decreto Legislativo 3/2011, de 14 de noviembre, que refunde el texto de la Ley de Contratos del Sector Público. En particular, ejecutará las actuaciones previstas en la cláusula segunda de acuerdo con lo previsto en el anexo X.
c) El SES asume la responsabilidad en el estricto cumplimiento de las previsiones establecidas en los artículos 107 y 108 del TFUE y normativa que los desarrolla, en particular en lo referente a las oportunas notificaciones y comunicaciones a la Comisión Europea que en su caso fuesen necesarias.
d) El SES, de conformidad con el artículo 125.4.b) del Reglamento (CE) 1303/2013, como beneficiario de la ayuda mantendrá un sistema de contabilidad separado para todas las transacciones relacionadas con las operaciones objeto de cofinanciación o, al menos, contará con una codificación contable adecuada que permita identificar claramente dichas transacciones, debiendo distinguir las partidas presupuestarias de la contabilidad nacional y comunitaria. Todo ello, sin perjuicio de las normas de contabilidad nacional.
e) El SES, de conformidad con lo dispuesto en la disposición adicional segunda b) de la ley 48/2015, de 29 de octubre, de Presupuestos Generales del Estado para el año 2016, acreditará que se encuentra al corriente del pago de las obligaciones de reembolso de cualesquiera otros préstamos o anticipos concedidos anteriormente con cargo a los Presupuestos Generales del Estado con anterioridad al pago establecido en el presente convenio. Asimismo acreditará que se encuentra al corriente de pago de sus obligaciones tributarias y con la Seguridad Social, y de sus obligaciones por reintegro de subvenciones. Para tal efecto, el beneficiario entregará cumplimentado el modelo establecido en el anexo XII, firmado por persona competente, con anterioridad a la firma del presente convenio de colaboración.
f) El SES se compromete a informar cuatrimestralmente a la SGCi de la ejecución del convenio en términos de los compromisos adquiridos, los gastos reconocidos y los pagados aportando la correspondiente conciliación bancaria mediante certificación del saldo de la cuenta del proyecto a final del cuatrimestre.
g) El SES, que será beneficiario de las ayudas FEDER, para realizar los procedimientos de contratación pública de innovación deberá realizar consultas previas al mercado, debiendo justificar su realización ante la SGCi. El beneficiario no podrá reservarse la explotación o comercialización con terceros de los resultados de los trabajos realizados, ni directamente ni a través de terceros, ni acometerá acciones que puedan introducir efectos de distorsión de mercado.
h) Los gastos que se justifiquen al MEIC estarán incluidos entre los considerados elegibles de acuerdo a lo dispuesto en la Orden HFP/1979/2016, de 29 de diciembre, por la que se aprueban las normas sobre los gastos subvencionables de los programas operativos del Fondo Europeo de Desarrollo Regional y del Fondo de Cohesión o norma que la sustituya pudiendo imputarse gastos generales en la medida prevista en ellas. En ningún caso se admitirán gastos generales justificados como cantidades a tanto alzado.
Quinta. Justificación de las actuaciones y gastos realizados.
a) El SES justificará la marcha de las actuaciones presentando una memoria cuatrimestral a la SGCi. Dicha memoria contendrá:
1. Un cuadro que recoja la ejecución presupuestaria de cada línea de actuación, en términos de cantidades comprometidas y efectivamente pagadas por el SES en el cuatrimestre. Junto con la documentación contable que avale dicho cuadro resumen.
2. Un listado de los principales avances de ejecución y su vinculación con los indicadores del anexo VII.
3. Conciliación bancaria mediante certificación del saldo de la cuenta del proyecto a final del cuatrimestre.
b) Justificación final a la finalización del plazo de ejecución de actuaciones. El SES tendrá la obligación de justificar a la SGCi los gastos elegibles realizados en la ejecución del proyecto mediante la presentación de una cuenta justificativa consistente en:
1. Certificación por órgano de control independiente del SES del código contable asignado al proyecto que permita identificar las transacciones relacionadas con el mismo, de la toma de razón contable de la ayuda concedida, de los gastos e inversiones del proyecto, de la salida de fondos para el pago de dichos gastos e inversiones y de la recepción de los bienes financiados. Asimismo se presentará cuenta justificativa completa (con copia de los documentos de gasto y pago).
2. Memoria económica consolidada firmada por el responsable legal del SES y de los gastos y pagos efectuados según modelo anexo III.
3. Declaración responsable relativa a la financiación de la actividad subvencionada, según anexo IV, que contendrá la relación de todos los ingresos o ayudas que la hayan financiado, con indicación de s u importe y procedencia, firmada por el representante legal y con sello del SES.
4. Declaración responsable, según anexo V, relativa al depósito de la documentación original, con la firma de los representantes legales del SES.
5. Acreditación del cumplimiento de las normas de publicidad. A este efecto se cumplimentará Declaración Responsable según modelo anexo VI. El material gráfico (fotografías, ejemplares de publicaciones,...) que evidencie el cumplimiento de estas normas, se facilitará al Ministerio en formato digital.
6. Cuestionario de los indicadores de resultado de la actividad según modelo del anexo VII.
7. Elaboración por parte del SES de la lista de control FEDER, según anexo VIII.
8. En el caso de contratos del sector público, certificado del cumplimiento de lo dispuesto en el Real Decreto Legislativo 3/2011, por parte del órgano de control.
9. En el caso de suministro de bienes de equipo y servicios de consultoría y asistencia técnica o prestaciones de análoga naturaleza, cuando el importe no supere la cuantía de 18.000 € (excluido el IVA) para suministros y servicios y de 50.000 € (excluido el IVA) para ejecución de obras, se presentarán, como mínimo, tres ofertas previas de diferentes proveedores. No será necesaria la presentación de dichas ofertas cuando se justifique que no existen en el mercado otras entidades suministradoras.
10. En el caso de bienes inscribibles en un registro público, escritura de inscripción donde conste el importe de la ayuda recibida y el período durante el cual el SES deberá destinar los bienes al fin concreto para el que se concedió la ayuda que no podrá ser inferior a cinco años. Para el resto de bienes la obligación de destino será de dos años.
11. Memoria de proyecto generador de ingresos de acuerdo con lo previsto en el anexo IX y normativa FEDER aplicable.
12. Memoria técnica justificativa: Se deberá incluir de forma concreta y detallada información sobre el desarrollo y el grado de cumplimiento del proyecto.
Se incluirán los siguientes puntos (en formato libre):
i. Objeto y finalidad del proyecto o actuación.
ii. Contenido y alcance del proyecto. Resultados obtenidos.
iii. Plan de trabajo, con referencia expresa a los hitos del proyecto recogidos en el cuestionario de solicitud.
iv. Descripción detallada y comprensiva de los conceptos imputados cargados en la aplicación de justificación, con referencia a su naturaleza, motivo de imputación y vinculación con el proyecto, así como sus posibles desviaciones respecto a lo presupuestado inicialmente.
v. Justificación de Indicadores: Acreditación de los niveles de ejecución de los indicadores recogidos en el anexo VII, firmado por el responsable legal del SES.
c) La justificación final de los gastos deberá realizarse durante los tres meses siguientes a la finalización del periodo de ejecución señalado en la cláusula octava. No obstante lo anterior, el MEIC aceptará una justificación anual para que el SES pueda acreditar los gastos incurridos hasta la fecha.
d) El impuesto sobre el valor añadido y demás tributos, sólo serán elegibles cuando el beneficiario de la ayuda los haya abonado y no sean susceptibles de recuperación o compensación, lo que deberá acreditarse fehacientemente por el SES.
Sexta. Sujeción a la normativa FEDER.
A efectos de lo dispuesto en el Reglamento (UE) n.º 1303/2013 del Parlamento Europeo y del Consejo de 17 de diciembre de 2013, el SES firmará la declaración responsable recogida como anexo II.
El apoyo a esta actuación será compatible con otras ayudas o subvenciones, cualquiera que sea su naturaleza y la entidad que las conceda, siempre que conjuntamente no superen el coste total de la actuación subvencionada, ni la cofinanciación FEDER supere el 80 % del coste financiable y se respeten la intensidad máxima aplicable y las normativas nacional y comunitaria en esta materia, especialmente la incompatibilidad entre diferentes fondos y programas operativos del mismo fondo. Se deberá comunicar, en su caso, a la SGCi y a la Comunidad Autónoma de Extremadura tanto el importe de las mencionadas ayudas como el origen de las mismas.
A esta ayuda le son de aplicación lo dispuesto en el Reglamento (UE) n.º 1301/2013 del Parlamento Europeo y del Consejo, de 17 de diciembre de 2013, sobre el Fondo Europeo de Desarrollo Regional y sobre disposiciones específicas relativas al objetivo de inversión en crecimiento y empleo y por el que se deroga el Reglamento (CE) n.º 1080/2006; el Reglamento (UE) n.º 1303/2013 del Parlamento Europeo y del Consejo, de 17 de diciembre de 2013, por el que se establecen disposiciones comunes relativas al Fondo Europeo de Desarrollo Regional, al Fondo Social Europeo, al Fondo de Cohesión, al Fondo Europeo Agrícola de Desarrollo Rural y al Fondo Europeo Marítimo y de la Pesca, y por el que se establecen disposiciones generales relativas al Fondo Europeo de Desarrollo Regional, al Fondo Social Europeo, al Fondo de Cohesión y al Fondo Europeo Marítimo y de la Pesca, y se deroga el Reglamento (CE) n.º 1083/2006 del Consejo; el Reglamento Delegado (UE) n.º 480/2014 de la Comisión, de 3 de marzo de 2014, que complementa el Reglamento (UE) nº 1303/2013 del Parlamento Europeo y del Consejo.
Séptima. Seguimiento y evaluación.
Para garantizar la correcta ejecución y el seguimiento de la ayuda FEDER asignada en este Convenio se constituirá una Comisión de Seguimiento integrada por seis miembros: tres personas designadas por el MEIC y tres designadas por el SES. La presidencia de la Comisión corresponde al MEIC a través de la SGCi. La secretaría de la Comisión la ejercerá un representante del SES.
En el plazo de un mes desde la firma del convenio, las partes designarán a sus representantes y lo comunicarán a las otras partes.
Esta comisión realizará el seguimiento de las actuaciones del convenio y conocerá las dudas y controversias que pudieran surgir en la aplicación e interpretación de las cláusulas del mismo, sin perjuicio de las facultades del MEIC como órgano de control de la ayuda concedida. A fin de poder ejercer sus labores de seguimiento, deberá facilitársele a la comisión en el cuarto trimestre de cada año un estado de la ejecución del proyecto en términos de los compromisos adquiridos, pagados o ejecutados.
Esta comisión de seguimiento no sustituye al órgano concedente en sus competencias conforme a lo establecido en la Ley, 38/2003, de 17 de noviembre, General de Subvenciones.
La comisión de seguimiento se reunirá al menos una vez al año. Con independencia de ello, se reconoce a cada parte firmante la facultad de convocar reuniones de la comisión.
Los miembros de esta comisión no generarán derecho económico alguno por su pertenencia a la misma.
Las posibles modificaciones necesarias para la finalización del proyecto deberán solicitarse, a través de la citada comisión, quien propondrá su aprobación a la SGCi, que será quien deberá resolver expresamente su concesión. Cuando las modificaciones impliquen la alteración de los términos del Convenio, las mismas deberán ser objeto de aprobación por acuerdo de las partes mediante la suscripción de la correspondiente Adenda al presente convenio, previo cumplimiento de todos los trámites y requisitos que resulten preceptivos.
En lo no contemplado por ésta cláusula, sobre el funcionamiento y actuaciones de la comisión, se estará a lo dispuesto por la Ley 40/2015, de 1 de octubre, de Régimen Jurídico del Sector Público, sobre órganos colegiados.
Octava. Duración, Plazo de ejecución del proyecto y prórroga.
El plazo de ejecución de actuaciones tendrá una duración máxima de cuatro años contados desde la fecha de entrada en vigor del mismo. Dicho período será destinado íntegra y exclusivamente a las actuaciones previstas en los anexos I, X y XI como tramo I o fase de I+D+i.
El plazo de ejecución de actuaciones podrá ser prorrogado de manera que en ningún caso tenga una duración de más de cuatro años contados desde la fecha de entrada en vigor del convenio.
El plazo de justificación final será de tres meses contados desde el final del plazo de ejecución.
Novena. Entrada en vigor, vigencia y prórroga.
El presente convenio entrará en vigor en el momento de su firma y su vigencia finalizará cuando se produzca el total cumplimiento de todas las obligaciones asumidas por las partes, entre las que se encuentra el total cumplimiento de la cancelación del anticipo y/o reintegro en su caso de las cantidades debidas. En cualquier caso el periodo de elegibilidad de los gastos se ajustará al periodo de ejecución de actuaciones de cada tramo establecido en la cláusula octava.
De conformidad con el artículo 48.8 de la Ley 40/2015, de 1 de octubre, de Régimen Jurídico del Sector Público, el convenio resultará eficaz una vez inscrito en el Registro Electrónico estatal de Órganos e Instrumentos de Cooperación del sector público estatal, al que se refiere la disposición adicional séptima y publicados en el «Boletín Oficial del Estado».
Décima. Resolución del Convenio.
a) En caso de extinción del convenio deberán concluirse las actuaciones iniciadas al amparo de este convenio, realizándose la liquidación económica y administrativa de las obligaciones contraídas hasta el momento.
b) Serán causas de su resolución y revocación, las siguientes:
1. El acuerdo expreso y escrito de las partes.
2. El incumplimiento por alguna de las partes de cualquiera de las prescripciones sustanciales contenidas en este convenio, lo que se comunicará por aquella que la invoque a las otras de manera fehaciente. Se considerarán prescripciones sustanciales los contenidos íntegros de los anexos I (apartados 5 y 6), X y XI.
3. La cancelación total o parcial del proyecto por causas imputables a cualquiera de los organismos beneficiarios del SES o a sus contratistas/subcontratistas.
4. La aplicación, por parte del SES de la financiación a finalidades y actuaciones distintas de las previstas en este convenio y en sus anexos I, X y XI.
5. El incumplimiento de la obligación de justificación cuatrimestral y/o final.
6. El incumplimiento de los indicadores FEDER asociados al marco de rendimiento, de acuerdo con lo establecido en el anexo VII.
7. El incumplimiento por parte del SES de las obligaciones derivadas de los artículos 107 y 108 del TFUE y normativa que los desarrolla, en particular en lo referente a las oportunas notificaciones y comunicaciones a la Comisión Europea que en su caso fuesen necesarias.
c) En el caso de resolución del convenio según lo establecido en los apartados anteriores procederá el reintegro de los importes correspondientes más los eventuales intereses de demora calculados de acuerdo con lo previsto en el artículo 38.2 de la Ley 38/2003, de 17 de noviembre, General de Subvenciones.
d) En cuanto a la forma en la que habrán de concluirse las actuaciones correspondientes al tramo I, se actuará de acuerdo con las normas específicas reguladoras del FEDER y los Fondos Estructurales.
e) En el caso de existir más de una parte beneficiaria, los distintos beneficiarios responderán solidariamente en caso de resolución total o parcial del convenio.
Undécima. Publicidad de las actuaciones.
Las partes firmantes se comprometen a hacer constar la colaboración del MEIC en todas las actividades informativas o de promoción en relación con las actuaciones contempladas en este Convenio. Asimismo, se comprometen a observar estrictamente la normativa aplicable en materia de publicidad de los Fondos Estructurales que cofinancian las actuaciones.
Dado que el proyecto está cofinanciado por el Fondo Europeo de Desarrollo Regional (FEDER), se realizará la mención correspondiente de acuerdo con lo establecido en el anexo XII, 2.2 del Reglamento (UE) n.º 1303/2013, de 17 de diciembre de 2013, y artículos 4 y 5 y anexo II del Reglamento de Ejecución (UE) n.º 821/2014, de 28 de julio de 2014.
Duodécima. Régimen jurídico.
El régimen jurídico aplicable será el establecido en la normativa comunitaria relativa a la aplicación de Fondos FEDER, se aplicará supletoriamente el régimen de la Ley 38/2003, de 17 de noviembre, General de Subvenciones, según lo establecido en su artículo 6 y en el artículo 7 de su Reglamento de desarrollo aprobado por Real Decreto 887/2006, de 21 de julio.
El Convenio se rige por lo dispuesto en el capítulo VI del título preliminar de la Ley 40/2015, de 1 de octubre, de Régimen Jurídico del Sector Público.
En prueba de conformidad, las partes firman el presente Convenio por duplicado ejemplar y a un solo efecto en el lugar y fecha anteriormente indicados.–Por el Ministerio de Economía, Industria y Competitividad, Juan María Vázquez Rojas, Secretario General de Ciencia e Innovación.–Por el Servicio Extremeño de Salud-SES, Ceciliano Franco Rubio, Director Gerente.
Desarrollo de un Sistema de Medicina Personalizada Aplicada (MEDEA)
Aunque se ha proclamado la necesidad de la aplicación generalizada de la Medicina Personalizada, aún existen barreras para extender su implementación, como son el uso exclusivo de la genética sin analizar variables fisiológicas o ambientales relevantes y la falta de aplicaciones informáticas que simplifique la toma de decisiones del prescriptor en la asistencia sanitaria. La mayoría de las aplicaciones se centran en un único fármaco, sin bien el problema radica en seleccionar la prescripción durante polimedicación en pluripatología. Las necesidades que se pretende solucionar son: 1) elección de fármaco y dosis adecuados, según la situación particular del paciente (consumo de otros fármacos, presencia de otras patologías, cambios fisiológicos, hábitos, etc.), y 2) proveer de una herramienta para la selección inteligente personalizada de individuos en estudios clínicos con fármacos.
ANEXO I
Memoria y presupuesto
Proyecto de Servicio Extremeño de Salud (SES) a la línea de fomento de la innovación desde la demanda. Al amparo del Programa Operativo FEDER de I+D+i 2014-2020
ÍNDICE
1. Objeto.
2. Entidades que colaboran.
2.1 MEIC
2.2 Beneficiario/s.
2.2.a) Servicio Extremeño de Salud (SES)
3. Líneas de actuación.
4. Ejecución del Convenio.
4.1 Oficina de proyecto.
4.2 Empleo CPI.
4.3 Cronograma.
5. Presupuesto.
6. Resultados.
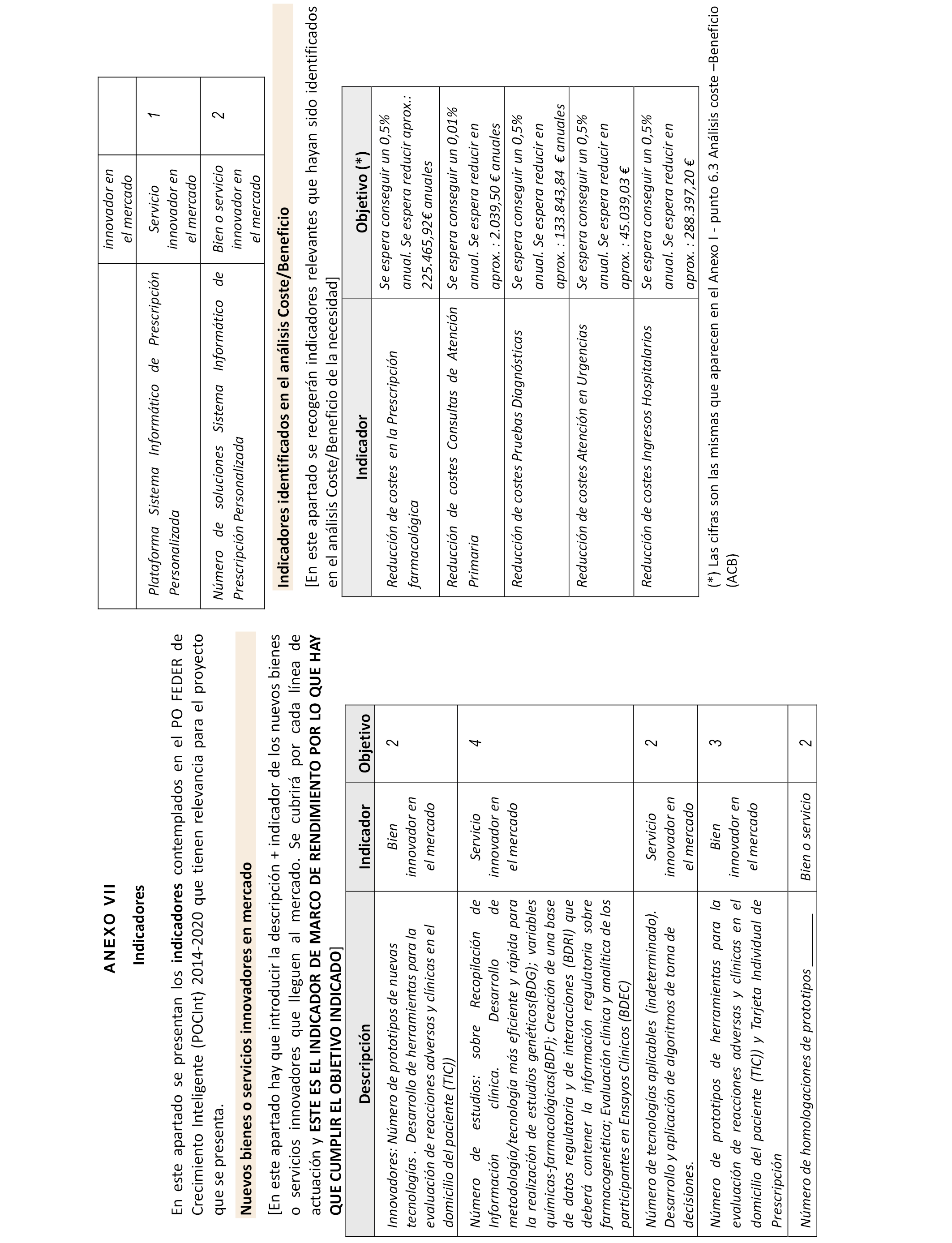
6.1 Nuevos bienes o servicios innovadores en mercado.
6.2 Mejoras del servicio público.
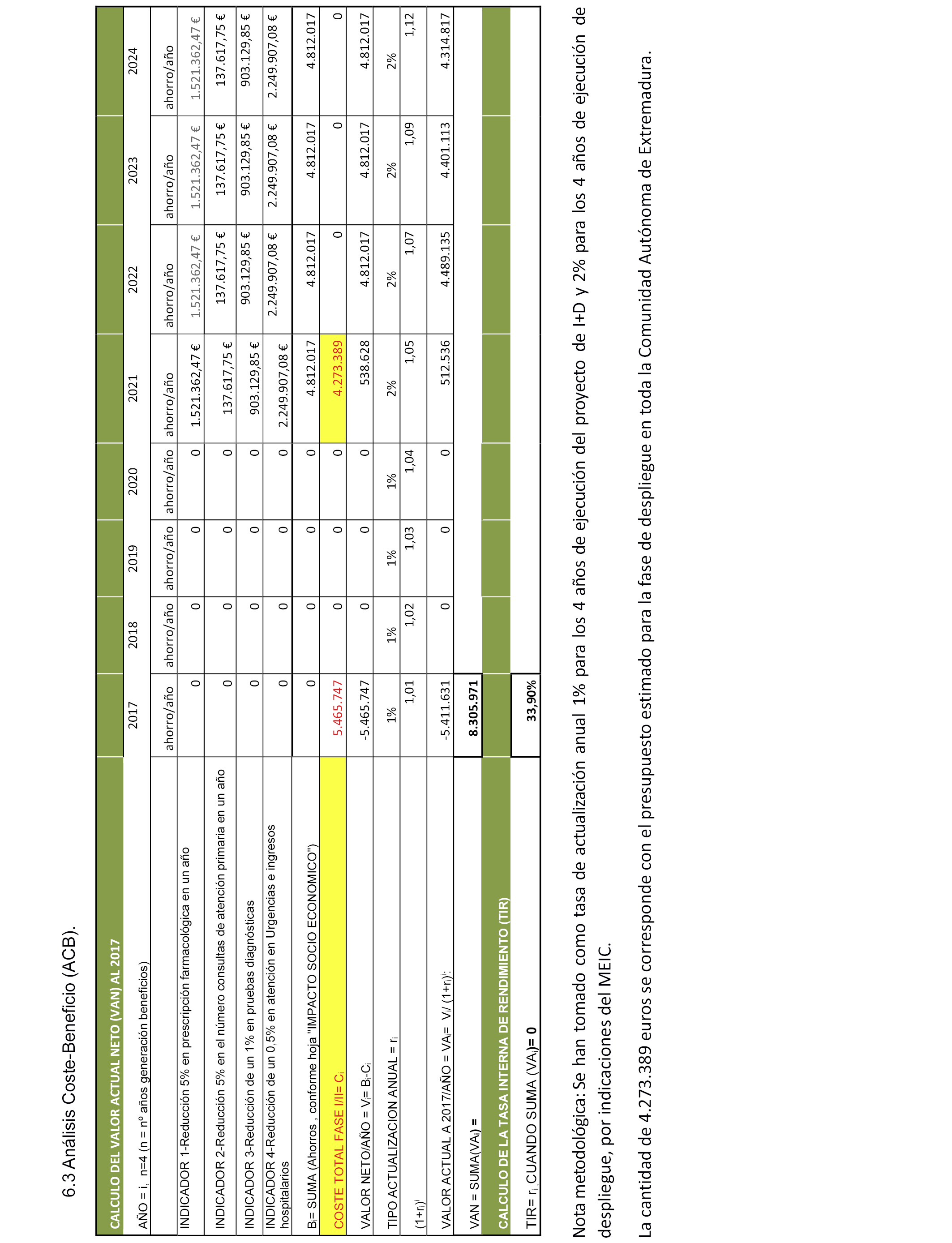
6.3 Análisis Coste-Beneficio (ACB).
1. Objeto
El objeto del presente convenio es la selección de proyectos para su cofinanciación por el FEDER 2014-2020, y más específicamente para el proyecto «Sistema de Medicina Personalizada Aplicada (MEDEA)».
Asimismo mediante el presente convenio se establecen las obligaciones y derechos del organismo beneficiario de los fondos FEDER, aplicados para la ejecución del antedicho proyecto.
El programa de innovación «Sistema de Medicina Personalizada Aplicada (MEDEA)» tiene por objetivo:
1. Desarrollar un programa de Prescripción Personalizada integrado en la historia clínica electrónica.
2. Algoritmo de traducción de la información cualitativa (genética) en cuantitativa (fenotipo).
3. Desarrollar los métodos analíticos y de laboratorio necesarios.
4. Desarrollar metodologías de evaluación de efectos farmacológicos en pacientes en su vida cotidiana.
«Sistema de Medicina Personalizada Aplicada (MEDEA)» se dirige a la población general de Extremadura (1,09 millones de habitantes) y, en particular a patologías mayoritarias (pacientes psiquiátricos, oncológicos y con dolencias cardiovasculares). El SES, atiende a la mayoría de la población extremeña, población bastante representativa de la media de la población española, sureuropea e íntimamente conectada con la iberoamericana. Entre la población extremeña, un 16,3 % declaró padecer una dolencia o enfermedad que afectó a su actividad diaria en los últimos 6 meses de 2012, siendo las enfermedades cardiovasculares las que más muertes producen, seguido de las enfermedades relacionadas con tumores. Durante 2011 se dieron un total de 114.721 altas hospitalarias principalmente relacionadas con enfermedades cardiovasculares y tumores. En cuanto a la salud mental, entre 2001-2005 el 5 % de la población había limitado su actividad durante al menos diez días por problemas psíquicos, porcentaje en aumento.
2. Entidades que colaboran
2.1 Ministerio de Economía, Industria y Competitividad (MEIC). La Secretaría de Estado de I+D+i (SEIDi) y, en particular, la Secretaría General de Ciencia e Innovación (SGCi) del Ministerio de Economía, Industria y Competitividad (MEIC), y, dentro de la misma, a través de la Subdirección General de Fomento de la Innovación (SGFI) tienen entre sus objetivos el impulso de la Compra Pública de Innovación como instrumento para mejorar los servicios públicos al tiempo que fortalecer las capacidades innovadoras de las empresas, de acuerdo con el Real Decreto 415/2016, de 3 de noviembre, por el que se reestructuran los departamentos ministeriales, y se crea el Ministerio de Economía, Industria y Competitividad (en adelante MEIC).
En particular la SGFI, en base a su experiencia como órgano impulsor de programas de CPI, asesorará a los beneficiarios en la definición de las arquitecturas financieras de CPI con objeto de maximizar el impacto en la innovación empresarial de la presente propuesta. Los beneficiarios consultarán preceptivamente con la SGFI en la elaboración y puesta en marcha de actuaciones de CPI así como en la definición de indicadores y medidas tendentes a fomentar la competitividad empresarial.
2.2 Servicio extremeño de salud (SES). El Servicio Extremeño de Salud (SES) es un servicio público universal que proporciona cobertura sanitaria a toda la población de la Comunidad Autónoma de Extremadura. El SES es un organismo autónomo de carácter administrativo, adscrito a la Consejería competente en materia sanitaria, dotado de personalidad jurídica propia y plena capacidad de obrar para el cumplimiento de sus fines, disponiendo de tesorería propia y facultades de gestión del patrimonio afecto.
Por lo tanto el SES cumple con las condiciones de servicio público según lo recogido en la Ley 10/2001, de 28 de junio, de Salud de Extremadura, el SES:
1. Ejerce exclusivamente obligaciones de servicio público;
2. las obligaciones y funciones del SES están claramente definidas en la mencionada Ley 10/2001, de 28 de junio, de Salud de Extremadura;
3. considerando este marco legal, es conveniente aclarar que cualquier entrada de dinero a través de este programa se realizará de forma objetiva y transparente, y evitando ventaja económica para el SES respecto a cualquier otra entidad.
4. la compensación económica estimada para este programa de innovación no superará el nivel necesario para cubrir total o parcialmente los gastos ocasionados.
5. finalmente todas las obligaciones de servicio público se van a realizar conforme a un procedimiento de contratación pública que permita seleccionar al candidato capaz de prestar estos servicios al menor coste para la colectividad. Por lo tanto el Servicio Extremeño de Salud cumple los requerimientos indicados en la STJCE de 24 de julio de 2003, Altmark.
3. Líneas de actuación
Este convenio se articula en torno a una línea de actuación u objetivos estratégicos.
Desarrollar un Programa de Prescripción Personalizada integrado con la historia clínica en base a la investigación genotípica y antecedentes y un Sistema de Estratificación Farmacogenómica de voluntarios sanos y pacientes participantes en Ensayos Clínicos (EC).
3.1 Descripción. La aplicación de la farmacogenética en la práctica médica es una necesidad, más del 30% de los fármacos aprobados por procedimiento centralizado europeo en la EMA contienen un biomarcador en su ficha técnica según el último informe del Pharmacogenomics Working Party de la EMA. La variabilidad genética y de estilo de vida puede explicar las diferencias individuales en la respuesta a medicamentos. Identificar a los pacientes con respuesta anormales al tratamiento podría permitir seleccionar el tratamiento concomitante de menor riesgo, ajustar su dosis individualmente y evitar así fracasos terapéuticos y disminuir costes derivados de la atención sanitaria por dichos fracasos terapéuticos o reacciones adversas. El conocimiento del genoma humano ha permitido avances en la individualización del tratamiento farmacológico, esta información sumada a la disponible sobre interacción genético ambiental puede aportar una evaluación única para cada paciente en cada situación, fundamentado las estrategias de MP.
3.2 Existencia de soluciones similares en el mercado. No existen en el mercado las aplicaciones que se pretenden desarrollar. El Proyecto EU-PIC, en el que participa y co-lidera el IP, ha reunido a todas las empresas activas en Europa. La mayoría se ocupan de un aspecto parcial, o bien innovan analíticamente, generan un programa en base a datos teóricos sin evaluación clínica y ninguna se plantea su aplicación a la investigación clínica. Existen chips –plataformas de genotipado– que intentan predecir las reacciones adversas a partir de la información casi exclusivamente del DNA genómico del paciente, aportando al prescriptor un informe que generalmente no está actualizado y es poco útil para la rutina clínica habitual. No está desarrollada la capacidad de incluir la Historia Clínica electrónica (interfase de conexión con el sistema JARA de historia médica electrónica del SES). El proyecto, por tanto, presenta diversas innovaciones útiles para el sistema sanitario y las empresas del sector en dos vertientes: la asistencia sanitaria y la investigación clínica.
3.3 Población objeto de la mejora del Servicio Público (Población Diana). Aplicación al (SES): Población general de Extremadura (1,09 millones de habitantes), si bien, la fase de validación del proyecto estará dimensionado a 3.000 pacientes del SES.
3.4 Objetivos globales del proyecto. MEDEA tiene como objetivo la implementación clínica de la Medicina Personalizada en Servicios de Salud e Investigación clínica, para mejorar la prescripción de medicamentos y aumentar la eficacia de los Ensayos Clínicos, permitiendo la prescripción farmacológica con menor probabilidad de presentar efectos adversos y la selección de voluntarios o pacientes con menor riesgo en investigación clínica. El proyecto generará mejora de calidad de vida en pacientes y ahorros en tratamientos farmacológicos, consultas médicas, en pruebas diagnósticas, tratamiento hospitalario, etc.
3.5 Objetivos específicos del Proyecto. Desarrollar un programa de Prescripción Personalizada integrado con la historia clínica en base a la investigación genotípica y antecedentes.
Desarrollar un algoritmo que traduzca la información cualitativa (genética) en cuantitativa (fenotipos metabólicos) para prescripción y ensayos clínicos.
Desarrollar los métodos analíticos y de laboratorio necesarios.
Desarrollar metodologías de evaluación de efectos farmacológicos en pacientes en su vida cotidiana.
3.6 Interacción entre los distintos objetivos, actividades, tareas… El desarrollo del proceso está interrelacionado. La información se obtendrá de la Asistencia Sanitaria (pacientes) e Investigación Clínica (voluntarios sanos). A esta información se le acompañará la evaluación genética y farmacológica, y la toma de datos de reacciones adversas de pacientes. Se generará el Programa de Prescripción (PPS) y la Tarjeta Farmacogenética (PPC). La información de la evaluación genética y farmacológica se incorporará al PPS y PPC, más la generación de las interfases de conexión a la historia clínica (JARA).
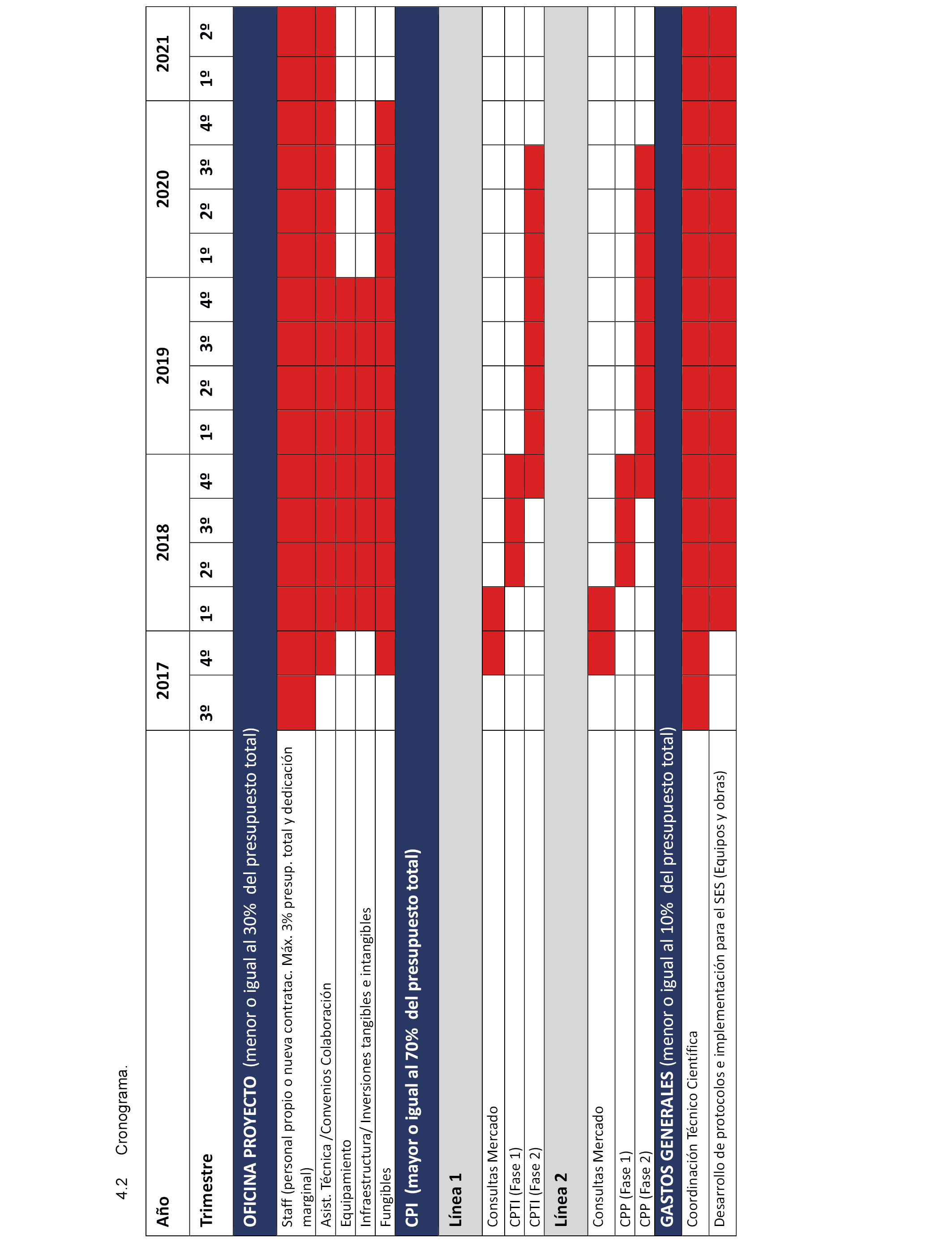
4. Ejecución del convenio y cronograma
4.1 Oficina de proyecto.
4.1.1 Equipo gestor:
Intervención & Control Financiero: Junta de Extremadura.
Asesoría Jurídica: SES.
Gestores: FundeSalud.
Mecanismos de coordinación: FundeSalud.
Otros:
La Fundación para la Formación e Investigación de los Profesionales de la Salud de Extremadura (FundeSalud) es una Fundación del Sistema Sanitario Público de Extremadura sin ánimo de lucro y con fines de interés general adscrita a la Consejería de Sanidad y Políticas Sociales de la Junta de Extremadura.
Su constitución fue autorizada mediante Decreto 62/2004, de 20 de abril, encontrándose inscrita en el Registro de Fundaciones de competencia estatal con el número 788 mediante Orden ECI/4550/2004, de 22 de diciembre, e incluida entre las entidades beneficiarias del mecenazgo, relacionadas en el artículo 16 de la Ley 49/2002, de 23 de diciembre.
En el artículo 23.–Financiación, de sus estatutos, aprobados en escritura pública el 5 de mayo de 2.016, ante el Ilmo. Sr. Notario, Gonzalo Fernández Puignaire, establece que la Fundación, para el desarrollo de sus actividades, podrá actuar como medio propio instrumental del sector público de cuantas Administraciones y/o Entidades públicas lo requieran, siempre en atención a los fines de la Fundación, siempre que ello no implique una limitación injustificada del ámbito de sus posibles beneficiarios ni contravenga la normativa vigente en materia de contratación, en función del perfil de ente contratante que haya suscrito de manera pública. Así mismo, y en virtud de lo antedicho, podrá contratar y convenir con organismos y entidades del sector privado la prestación de servicios.
4.1.2 Equipo técnico. Equipo Técnico (Investigadores, doctores, especialistas intensificados, especialistas a dedicación completa, etc.).
La Oficina Técnica (OT) estará constituida por gestores de la entidad beneficiaria y una Oficina Técnica a contratar, con experiencia en la ejecución de proyectos con CPI y gestión de proyectos de I+D, conocedora de la estructura y organizaciones de la Comunidad Autónoma de Extremadura.
La Unidad de Medicina Personalizada (MP) consta de dos áreas:
1. Área de Tratamiento de Información Científica.
2. Área de Validación Clínica.
El personal propio será personal sanitario especialista con intensificación de jornada y dedicación parcial.
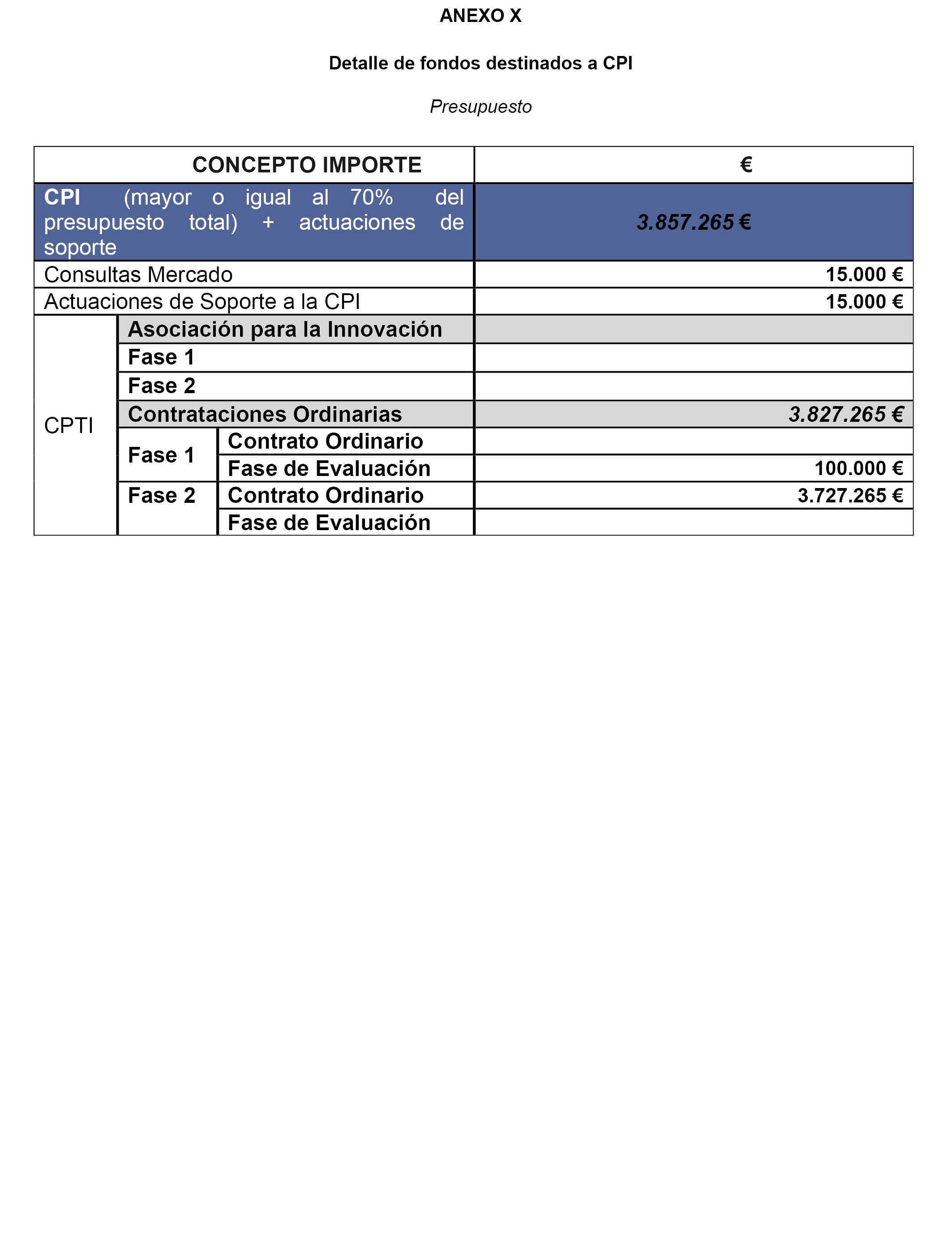
4.2 Empleo CPI. Las CPI a ejecutar en el proyecto MEDEA se desglosan en 5 Subproyectos de ejecución a través de los instrumentos de CPI.
SUBP 1. Sistema de Prescripción Personalizada (Personalize Prescription System)-TIC.
SUBP 2. Laboratorio Molecular.
SUBP 3. Laboratorio Farmacológico.
SUBP 4. Análisis en unidades de Ensayos Clínicos.
SUBP 5. Desarrollo de herramientas para la evaluación de reacciones adversas y clínicas del paciente.
Estas necesidades se van a cubrir por mecanismos las Compras Públicas de Innovación se van a cubrir por mecanismos de CPTI preferentemente.
En su ejecución, se desarrollará un Software de Prescripción Personalizada (PPS) integrado con la historia clínica en base a la investigación genotípica y antecedentes, que prevé tres paquetes de trabajo que podrían desglosarse en, al menos, tres lotes de CPTI:
1. SUBP 1. Sistema de Prescripción Personalizada (Personalize Prescription System)-TIC.
a) Creación de una base de datos regulatoria y de interacciones (BDRI) que deberá contener la información regulatoria sobre farmacogenética a nivel español y europeo, completándola con evidencias científicas, principalmente en lo referente a interacciones farmacológicas.
b) Desarrollo Software de un Programa de Prescripción Personalizada (PPS.0 - versión de partida) que integre la BDRI para manipular y seleccionar el fármaco adecuado para la prescripción y que última instancia conectable al sistema de historia clínica electrónica, a través de tarjeta sanitaria de prescripción.
c) Integración de los algoritmos generados en SUBP.4.b y SUBP.5.c en el PPS y conexión al sistema preexistente (compatible con sistema de historia clínica electrónica).
Para evaluar el programa se precisan los siguientes desarrollos:
Un segundo subproyecto (SUBP 2), que prevé un solo paquete de trabajo con un lote de CPP.
2. SUBP 2. Laboratorio Molecular. Desarrollo de metodología/tecnología más eficiente y rápida para la realización de estudios genéticos y aplicación a una selección de 3.000 pacientes, creando una base de datos genética (BDG).
Un tercer subproyecto (SUBP 3), que prevé un solo paquete de trabajo con un lote de CPP.
3. SUBP 3. Laboratorio Farmacológico. Desarrollo de metodología/tecnología más eficiente y rápida para el estudio de variables químicas-farmacológicas relacionadas con las reacciones adversas y aplicación a una selección de 3.000 pacientes, generando una base de datos (BDF).
Un cuarto Subproyecto (SUBP 4), que prevé tres paquetes de trabajo que podrían desglosarse en 2 lotes de CPP.
4. SUBP 4. Análisis de Unidades de Ensayos Clínicos. Evaluación clínica de pacientes y/o voluntarios sanos participantes en ensayos clínicos
a) Estudio y evaluación clínica y analítica de los participantes en Ensayos Clínicos, generando una base de datos para el PPS (BDEC).
b) Desarrollo de un algoritmo de traducción de la información obtenida para la toma de decisiones, que permita al PPS seleccionar el paciente o voluntario idóneo para un determinado Ensayo Clínico generando PPS.1-ic (investigación clínica).
Con lo ejecutado hasta este subproyecto, se habrán desarrollado los elementos para cubrir los objetivos del Sistema de Estratificación Farmacogenómica de voluntarios sanos y pacientes participantes en Ensayos Clínicos (EC).
Un último Subproyecto (SUBP 5) que prevé tres paquetes de trabajo que podrían desglosarse en, al menos, 3 lotes, uno de CPP y 2 de CPTI:
5. SUBP 5. Evaluación de reacciones adversas y clínicas
a) Estudio y evaluación clínica de los pacientes, principalmente respecto de reacciones adversas, tras tratamiento farmacológico, generando una base de datos para el PPS.
b) Desarrollo de herramientas y/o dispositivos que permitan tomar datos de parámetros vitales y efectos secundarios en pacientes para evaluación clínica.
c) Desarrollo de un algoritmo para la toma de decisiones, que permita al PPS determinar qué fármaco y prescripción es idónea para cada paciente generando PPS.1.
Los objetivos para obtener un programa de Prescripción Personalizada integrado con la historia clínica en base a la investigación genotípica y antecedentes, quedan completamente cubiertos con la ejecución de todos los paquetes de trabajo, ya que están interrelacionados.
El procedimiento diseñado para este proyecto consistirá en primer lugar, en la realización de consultas previas al mercado, para lo que se prevé organizar encuentros con los operadores del mercado que pudieran estar interesados en proveer de soluciones tecnológicas e innovadoras a las demandas del SES, expresadas previamente en el Mapa de Demanda Temprana publicado por el SES en el Perfil del Contratante.
Las consultas al mercado serán convocadas utilizando las plataformas digitales a disposición del SES, así como los medios oficiales, como DOE o BOE, y anuncios en prensa especializada.
Para la evaluación de las propuestas de los operadores del mercado se contará con la participación de Mesas o Paneles de Expertos tanto del SES, como externos al SES, compuestas por especialistas de reputado prestigio nacional e internacional en las disciplinas correspondientes.
Así mismo, estos paneles de expertos participarán en la elaboración definitiva de los Pliegos de Prescripciones Funcionales de cada uno de los lotes de CPI, así como asesores de las Mesas de Contratación en la evaluación técnica de las propuestas (criterios de valoración cualitativos) presentadas por los licitantes.
El proceso de licitación estará compuesto por varias licitaciones ordinarias y lotes de CPI.
El procedimiento elegido será en dos fases y evaluables en 4 hitos.
Tras la recepción de las propuestas de los licitantes en la Fase I, se invitarán hasta un máximo de 4 licitantes a participar en la Fase II, en la cual recibirán una retribución fija de un máximo de 5.000 euros, por su participación y presentación de la documentación requerida en esta Fase II.
En la Fase II se establecerá, por lo general, un máximo de 2 adjudicatarios por cada lote, que serán evaluados en los correspondientes hitos establecidos (máximo de 4 hitos), estableciéndose la posibilidad de finalizar el contrato si los expertos consideran que los desarrollos realizados en la evaluación de cualquiera de los hitos no satisface las demandas tecnológicas planteadas por el SES, retribuyendo el contrato según los siguientes porcentajes en función del presupuesto adjudicado a cada operador del mercado:
Hito 1: 15 %.
Hito 2: 25 %.
Hito 3: Hasta 50 %.
Hito 4: 10 % o más (en función del porcentaje fijado en el Hito 3) correspondientes con la etapa de validación y pruebas.

6. Resultados
6.1 Nuevos bienes o servicios innovadores en mercado. El proyecto MEDEA pretende desarrollar, por una parte, un Programa de Prescripción Personalizada integrado con la historia clínica en base a la investigación genotípica y antecedentes y un Sistema de Estratificación Farmacogenómica de voluntarios sanos y pacientes participantes en Ensayos Clínicos (EC).
Ambas líneas tendrán, sobre la base común de un programa informático que interrelaciona varias bases de datos generadas al efecto en el proyecto, dos algoritmos independientes que interrelacionan y/o correlacionan las distintas variables que intervienen en cada uno de los procesos decisorios.
6.2 Mejoras del servicio público. Las mejoras que se esperan de las dos líneas de trabajo de MEDEA son las siguientes:
En la Línea 1: Desarrollo de un programa de Prescripción Personalizada integrado con la historia clínica en base a la investigación genotípica y antecedentes, se espera:
Un programa de Prescripción Personalizada integrado con la historia clínica en base a la investigación genotípica y antecedentes que permita al PPS determinar qué fármaco y prescripción es idóneo para cada paciente, traduciéndose en ahorros operativos, ya que se disminuirán las visitas en centro de salud, atención especializada y urgencias hospitalarias, así como pruebas diagnósticas, debido a fallos en la medicación o reacciones adversas, causa principal del incremento de costes del sistema sanitario.
En la línea 2: Desarrollo de un sistema de Estratificación Farmacogenómica de voluntarios sanos y pacientes participantes en Ensayos Clínicos (EC), se espera:
Optimización de ensayos clínicos, seleccionando los participantes más adecuados, según sus características genéticas. De esta manera se podrán seleccionar a los pacientes farmacogenéticamente, y se evitará incluir en los ensayos clínicos a aquellos sujetos predispuestos a reacciones adversas o a niveles plasmáticos anormales, de fármacos y/o metabolitos. Se constituirá una nueva generación de Unidades de Ensayos Clínicos con capacidad de estratificar a los participantes en base a su perfil fármacogenético.
ANEXO II
Declaración responsable para actuaciones cofinanciadas por el FEDER
A efectos de lo dispuesto en el Reglamento (UE) n.º 1303/2013 del Parlamento Europeo y del Consejo, de 17 de diciembre de 2013,
Don Ceciliano Franco Rubio, en representación de la entidad Servicio Extremeño de Salud (SES), con CIF G0600413-I y domicilio social en Av. de las Américas, 2, de Mérida, provincia de Badajoz, según Decreto 194/2015, de 17 de julio, por el que se dispone el nombramiento como Director Gerente del Servicio Extremeño de Salud, otorgado con fecha 18/7/2015 en el «Diario Oficial de Extremadura».
DECLARA
1. Que está informado, conforme a lo dispuesto en el artículo 125 del Reglamento (UE) n.º 1303/2013 del Parlamento Europeo y del Consejo, de 17 de diciembre de 2013, de los puntos siguientes:
– Las condiciones específicas relativas a los bienes entregados o servicios prestados en el marco de la operación.
– Las condiciones de financiación de la operación (plan de financiación).
– El plazo límite de ejecución.
– La normativa a aplicar.
– La información financiera y de otro tipo que se ha de conservar, comunicar y facilitar cuando sea requerido.
2. Que ha recibido las orientaciones adecuadas para la ejecución y puesta en marcha de los procedimientos de gestión y control que sean necesarios para el buen uso de los Fondos, incluyendo la lista de comprobación FEDER (Fondos FEDER 2014-2020).
3. Que no se da el caso de la doble financiación del gasto declarado con otros regímenes comunitarios o nacionales y con otros períodos de programación.
4. Que realizará declaración de otros ingresos o subvenciones que hayan financiado la actividad con indicación de su importe y procedencia.
5. Que, de conformidad con el artículo 125.4.b) del Reglamento (UE) n.º 1303/2013 del Parlamento Europeo y del Consejo, de 17 de diciembre de 2013, como beneficiario/coordinador/responsable de la ayuda (así como los otros organismos participantes en la ejecución de las operaciones, si los hubiere) está obligado a mantener un sistema de contabilidad separado para todas las transacciones relacionadas con las operaciones objeto de cofinanciación o, al menos, cuento con una codificación contable adecuada que permita identificar claramente dichas transacciones, debiendo distinguir las partidas presupuestarias de la contabilidad nacional y comunitaria. Todo ello, sin perjuicio de las normas de contabilidad nacional.
6. Que, de conformidad con el artículo 125.4.d) y el artículo 140.1 del Reglamento (UE) n.º 1303/2013 del Parlamento Europeo y del Consejo, de 17 de diciembre de 2013, se dispone de toda la documentación sobre el gasto, las verificaciones y las auditorías necesarios para contar con una pista de auditoría apropiada, la cual conservará hasta tres años a partir del 31 de diciembre siguiente a la presentación de las cuentas en las que estén incluidos los gastos de la operación. No obstante lo dispuesto en cuanto a la documentación justificativa, para dar cumplimiento a lo establecido en los citados artículos 125.4.d) y 140.1 y 3) del Reglamento (UE) n.º 1303/2013 del Parlamento Europeo y del Consejo, de 17 de diciembre de 2013, sobre las garantías sobre la disposición de toda la documentación sobre el gasto, las verificaciones y las auditorías necesarios para contar con una pista de auditoría apropiada, está informado de que deberá presentar, junto con los otros documentos señalados para la justificación, un CD con el conjunto de facturas y de comprobantes de gasto y pago.
7. Que, dentro de su esquema organizativo, cumple con lo dispuesto en el artículo 115 del Reglamento (UE) 1303/2013 y en el anexo XII apartado 2.2 de dicho Reglamento, en donde se definen las responsabilidades de los beneficiarios relativas a las medidas de información y publicidad destinadas al público. Para ello, toda referencia en cualquier medio de difusión a la citada actuación y a los logros conseguidos deberá incluir que la misma ha sido objeto de ayuda con cargo al presupuesto de gastos del Ministerio de Economía, Industria y Competitividad y del Fondo Europeo de Desarrollo Regional, cuando dicha ayuda esté cofinanciada por el citado Fondo, dando así cumplimiento a lo establecido en el Reglamento (UE) n.º 1303/2013 del Parlamento Europeo y del Consejo, de 17 de diciembre de, sobre medidas de información y publicidad.
8. Que ha sido informado de las obligaciones medioambientales que comporta la cofinanciación FEDER.
9. Que, de conformidad con lo dispuesto en los Reglamento (UE) n.º 1303/2013 del Parlamento Europeo y del Consejo, de 17 de diciembre de 2013, autoriza al MINECO a facilitar copia autentificada de esta declaración de responsabilidad a la autoridad de gestión del FEDER.
10. Se autoriza al órgano gestor de la ayuda para que se pueda proceder a la cesión de la información correspondiente, cuando se establezcan mecanismos telemáticos para poder obtener esa información, y acepta ser incluido en la lista pública que se recoge en el artículo 115 del Reglamento (UE) n.º 1303/2013 del Parlamento Europeo y del Consejo, de 17 de diciembre de 2013.
11. Que, de conformidad con el artículo 125.3. e) del Reglamento (UE) n.º 1303/2013 del Parlamento Europeo y del Consejo, de 17 de diciembre de 2013, si la operación ha comenzado antes de presentarse una solicitud de financiación, se ha cumplido con la normativa aplicable a la operación.
12. Que, de conformidad con el artículo 125.3 f) del Reglamento (UE) n.º 1303/2013 del Parlamento Europeo y del Consejo, de 17 de diciembre de 2013, no se incluyen actividades que eran parte de una operación que ha sido o hubiera debido ser objeto de un procedimiento de recuperación conforme al artículo 71, a raíz de una relocalización de una actividad productiva fuera de la zona del programa.
13. Por último, que, asimismo, de conformidad con el artículo 125.3.d) del Reglamento (UE) n.º 1303/2013, como beneficiario, tiene capacidad y está dispuesto para cumplir las condiciones enumeradas con anterioridad, así como la normativa comunitaria, nacional y, en su caso, autonómica o local que le afecte.
Y para que así conste a los efectos legales de poder obtener la condición de beneficiario de una ayuda, firma la presente declaración
En ........................................., a ...... de ............................... de 2017
Fdo. Ceciliano Franco Rubio
(Firma del representante legal y sello de la entidad)


ANEXO V
Declaración responsable sobre depósito de justificantes
Don Ceciliano Franco Rubio, en representación de la entidad Servicio Extremeño de Salud (SES), con CIF G0600413-I y domicilio social en av. de las Américas, 2, de Mérida, provincia de Badajoz, según Decreto 194/2015, de 17 de julio, por el que se dispone el nombramiento como Director Gerente del Servicio Extremeño de Salud, otorgado con fecha 18/7/2015 en el «Diario Oficial de Extremadura».
DECLARA
Que, de conformidad con el artículo 125.4.d) y 140.1 y 3) del Reglamento (UE) n.º 1303/2013 del Parlamento Europeo y del Consejo, de 17 de diciembre de 2013, sobre las garantías sobre la disposición de toda la documentación sobre el gasto, las verificaciones y las auditorías necesarios para contar con una pista de auditoría apropiada, conservará toda la documentación justificativa hasta dos años a partir del 31 de diciembre siguiente a la presentación de las cuentas en las que estén incluidos los gastos definitivos de la operación concluida.
Que la documentación original (justificantes de gasto y pago y demás documentos requeridos por la normativa de aplicación) relativa a la ayuda concedida para el proyecto «Sistema de Medicina Personalizada Aplicada-MEDEA», para el cual fue concedida una ayuda en forma de Anticipo Reembolsable por un importe de 4.372.598 €, se encuentra depositada en Fundesalud, en la calle Pío Baroja, 10, de la ciudad de Mérida (Badajoz).
Y para que así conste, firma la presente en ..............., a ..... de .................. de 20
Ceciliano Franco Rubio,
Director Gerente del Servicio Extremeño de Salud-SES
Firma del representante legal y sello de la entidad





ANEXO DE CÁLCULO
RESUMEN FINANCIERO:
GASTOS:
INGRESOS:

ANEXO XII
Declaración responsable para libramiento
D. Ceciliano Franco Rubio, en calidad de Director Gerente del Servicio Extremeño de Salud (SES) de la Comunidad Autónoma de Extremadura, con CIF G0600413-I.
DECLARA
Que el Servicio Extremeño de Salud se encuentra al corriente de pago de las obligaciones de reembolso de cualquier préstamo o anticipo concedido con cargo a los Presupuestos Generales del Estado, conforme a la disposición adicional segunda.b) de la Ley 48/2015, de 29 de octubre, de Presupuestos Generales del Estado para el año 2016.
Que el Servicio Extremeño de Salud se encuentra al corriente de obligaciones tributarias y frente a la seguridad social, no ser deudora de obligaciones por reintegro de subvenciones, en los términos establecidos en el artículo 21 del Real Decreto 887/2006, de 21 de julio, por el que se aprueba el reglamento de la Ley General de Subvenciones.
Igualmente declara que el Servicio Extremeño de Salud no se halla incursa en ninguna de las restantes prohibiciones para obtener la condición de beneficiario que regula el artículo 13.2 y 13.3 de la Ley 38/2003 de 17 de noviembre, General de Subvenciones.
Y para que así conste a los efectos legales de poder obtener la condición de beneficiario así como el cobro de la ayuda, firma la presente declaración.
Y para que así conste, firma la presente en ..............., a ..... de ................. de 20....
Fdo.: Ceciliano Franco Rubio,
Director Gerente del Servicio Extremeño de Salud-SES
(Nombre completo y cargo)
